| « Április 2016 » | ||||||
| H | K | Sze | Cs | P | Szo | V |
| 1 | 2 | 3 | ||||
| 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| 25 | 26 | 27 | 28 | 29 | 30 | |
14:09 Kémia_4 |
Kémia története 4.rész XIX. század első fele, klasszikus kémia kialakulása A XVIII. század felszínre hozta a kémiai tudománynak azokat a fontos építőköveit, amelyekre alapozva tovább lehetett bővíteni a kémiai ismeretek tárházát. Tisztázódott a kémiai elem fogalma, összességében 33 különböző elemet azonosítottak. Az égés folyamatának megértése évezredes tévelygésnek vetett véget, jó úton haladt az egységes kémiai nevezéktan kialakítása. A századforduló tudósai tovább erősítették ezt a tendenciát. Jeremias Benjamin Richter (1762-1807) német vegyész kidolgozta a sav-lúg titrálások analitikai módszerét. Rájött, hogy az azonos mennyiségű savat semlegesítő különböző mennyiségű bázisok egyenértékűek egymással, tehát mindegy, hogy egy ismert koncentrációjú káliumhidroxiddal, vagy nátriumhidroxiddal, vagy más lúgoldattal közömbösítünk egy ismeretlen koncentrációjú savat, meg tudjuk határozni a sav mennyiségét. Joseph-Loiis Proust (1754-1826) francia vegyész megállapította, hogy az egyes vegyületekben az elemek állandó súlyarányban szerepelnek. Ezzel a felismeréssel az újkori atomelmélet előfutárává vált. A századforduló legfurcsább tudósa Henry Cavendish (1731-1810) angol kémikus és fizikus volt. Ő volt a legarisztokratább a sok arisztokrata származású kémikus közül. Apai nagyapja Devonshire második hercege volt, anyja pedig Kent hercegének a leánya. A család mindkét ága érdeklődött a természettudományok iránt. Apja egy ideig parlamenti képviselő volt, de 37 évesen visszavonult a politikától, hogy szenvedélyének, a tudománynak hódolhasson. Édesanyja, Anne de Grey tüdőbetegséggel küszködött, 1733 nyarán egy második fiúgyereknek adott életet, de ősszel meghalt. Apja, Charles Cavendish soha nem nősült meg újra, így Henry anya nélkül nőtt fel, talán ez okozta későbbi különc viselkedését. Kutatásait visszavonultan végezte, eredményeit nem, vagy túl későn publikálta. Feljegyzései szerint 1764-ben kidolgozta az arzénsav előállításának módszerét, amit tőle függetlenül Wilhelm Scheele 1775-ben fedezett fel és tett közzé. Nitrogén gázt különített el, megmérte a sűrűségét, de ezt sem publikálta. Legjelentősebb kémiai tárgyú kísérleteiben fémeket reagáltatott savakkal, meghatározta a keletkező gáz sűrűségét, vizsgálta robbanó képességét különböző arányú levegő eleggyel. Azt gondolta, hogy a reakcióban keletkező gáz, amit „gyúlékony levegőnek” nevezett el, a fémekből fejlődik savak hatására, de a valóság ennek éppen fordítottja, a fémek bontják el a savakat. Neve leginkább gravitációs méréseivel fonódott össze, bár a kísérlet ötlete nem tőle, hanem régi barátjától, John Micheltől származott, aki 1793-ban meghalt, mielőtt a kísérletet elvégezhette volna. Berendezése Cavendishhez került, mert ő volt az egyetlen, aki szóba jöhetett a kísérlet végrehajtására. Cavendish újjáépítette a berendezést és meghatározta vele a Föld átlagos sűrűségét, amit a vízéhez viszonyítva 5,48-szor nagyobbnak talált. (akkor még nem létezett az SI mértékrendszer, ezért nem g/cm3-ben adta meg) A ma elfogadott érték 5,52 g/cm3, ami azt jelenti, hogy a mérési hiba alig több mint 1% volt. Eötvös Lóránd ezt a mérési elvet fejlesztette tovább gravitációs kísérleteiben. A XIX század elejére az anyag atomos szerkezete egyre inkább elfogadottá vált a kémikusok körében, eljött az ideje annak, hogy valaki 2200 évvel Démokritosz után újra fogalmazza az atomelméletet. Ezt a hiányt John Dalton (1766-1844) angol kémikus és fizikus pótolta. John Dalton egy kvéker takács fiaként született Eaglesfieldben. (a kvékerek szigorú erkölcsi szabályok szerint, papság és szertartások nélkül élő vallási közösségek, melyek a 17. században alakultak meg Angliában) Egy kvéker magániskolában kezdte tanulmányait, 15 évesen bátyja, Jonathan mellé szegődött, hogy segítsen egy kvéker iskola működtetésében a közeli Kendalban. Később a manchesteri New College kvéker iskola matematika és természettudományok tanára lett. Tudományos érdeklődése igen sokrétű volt. Hatéves korában derült ki róla, hogy dikromata (színtévesztő), emiatt jelentős kutatásokat végzett a színvakság és a színtévesztés területén. A vörös és zöld színek összetévesztését ma is daltonizmus néven ismeri az orvosi szaknyelv. 1793-ban, 27 évesen publikálta „Meteorological Observations and Essays” című munkáját, amely azonban nem sok érdeklődést váltott ki a korabeli tudósok körében. Rengeteg kísérletet végzett gázokkal, róla nevezték el az ideális gázok elegyeire vonatkozó törvényt, miszerint az elegy össznyomása egyenlő az alkotók parciális nyomásának összegével. (Pö=P1+P2+…Pn) Atomelméletét 5 pontban foglalta össze:
Megállapításai kémiai értelemben ma is igazak, a radioaktivitás, az izotópok, a maghasadás felismerése óta kiegészítésekre szorulnak. Relatív atomsúly táblázatot állított össze, melyben a hidrogén atomsúlyát vette egynek. Az atomi tömegegységet ma is daltonnak nevezik. Minden korábbi felfedezés, ismeret ellenére valami továbbra is hiányzott a kémia eszköztárából ahhoz, hogy az ugrásszerű fejlődés beinduljon. Ez a valami kívülről, a fizika oldaláról érkezett meg és Alessandro Volta (1745-1827) elektromos oszlopa testesítette meg. Volta oszlopa állandó egyenáramot szolgáltatott és alkalmas volt a különböző oldatok elektrolízisére.
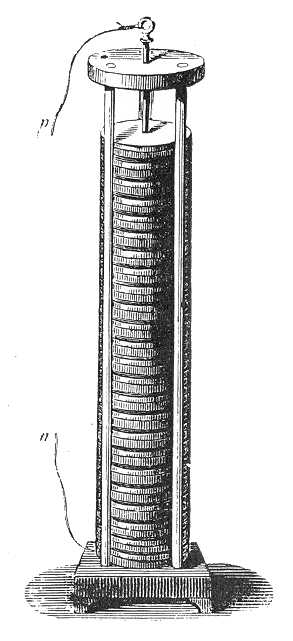
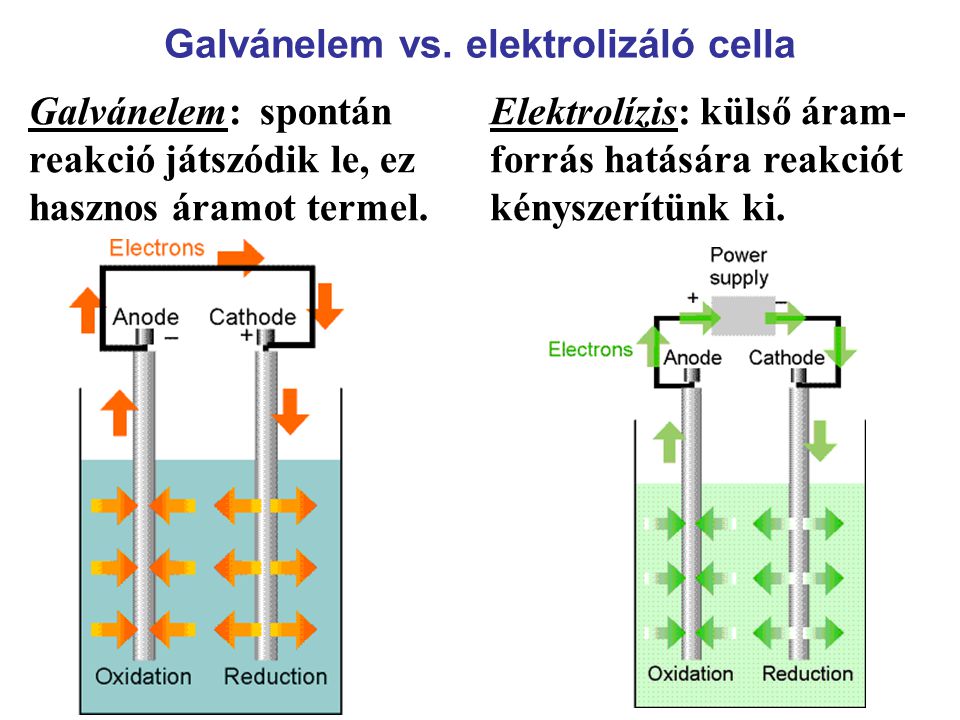
Nem hasonlított a mai akkumulátorokra, egymás fölé helyezett két különböző fémből készült korongokból állt, melyeket nedves papírlemezek választottak el egymástól. Minél magasabb volt az oszlop, annál nagyobb feszültség alakult ki a sarkok között. A korongok lehettek ezüst és réz pénzérmék, így az oszlopot bárki, házilag is elkészíthette. Ha elektromos áramot vezetünk egy oldatba, vagy olvadékba, akkor az addig kifelé semleges molekulák pozitív és negatív töltésű alkotórészekre, mai szóhasználattal ionokra esnek szét, a pozitív töltésű ionok a negatív töltésű elektróda, a katód, a negatív töltésűek pedig a pozitív elektróda, a katód felé vándorolnak, ahol elektront felvéve, vagy leadva semleges töltésű atomokká, illetve molekulákká alakulnak. Az alábbi ábra egy galvánelem és egy elektrolizáló cella sematikus rajzát és működési elvét ábrázolja. A galvánáram megnevezést maga Volta vezette be Luigi Galvani (1737-1798) iránti tiszteletből annak ellenére, hogy közöttük kemény tudományos csatározás zajlott a keletkező áram mibenlétéről. Luigi Galvani, mint a Bolognai Egyetem anatómia professzora észrevette, hogy a békacombok két különböző fémmel érintkezve összerándulnak. Az így létrejött áramot állati eredetűnek tartotta. Ennek volt is alapja, ha az elektromos rájákra, vagy angolnára gondolunk. Volta később bebizonyította, hogy az áramforrás nem a békacomb, hanem a két különböző fém.
Annak ellenére, hogy a két konstrukció megegyezik, működésük ellentétes, az egyik áramot termel, a másik áramot fogyaszt. Egy konkrét példa az elektrolízis folyamatára a sósav bontása.
A fémek és a hidrogén mindig a katódon, az oxigén és a savmaradékok mindig az anódon válnak le. Az új technikában rejlő lehetőséget elsőként Humphry Davy (1778-1829) angol kémikus ragadta meg. Davy egy fafaragó fiaként született Penzance-ben. 9 éves volt, amikor a család Varfellbe költözött, őt édesanyja keresztapja John Tonkin fogadta magához, hogy elemi iskoláit Penzance-ben folytathassa. Középiskolai tanulmányait a Truro Grammer School-ban fejezte be 1793-ban. Apjának 1794-ben bekövetkezett halála után Tonkin egy penzance-i orvoshoz, John Bingham Borlasehez küldte Davyt gyakornoknak. A rendelőhöz tartozó gyógyszertárban vált kémikussá, első kísérleteit a Tonkin ház padlásszobájában végezte a rokonság nem kis aggodalmától kísérve. 19 évesen Bristolban kezdte meg természettudományi tanulmányait, ugyanitt fedezte fel a kéjgázt (dinitrogénoxid) és annak élettani hatásait. Első könyvének megjelenése után (Reseaches, Chemical and Philosophical, 1799) kinevezték a Royal Institution tanárának. Előadásai, amelyekben a kéjgáz hatását is látványosan demonstrálta, nagy tömegeket vonzottak és az előkelő társasági körökben is népszerűekké váltak. Egyik előadásán két jégdarab összedörzsölésével, melyek a dörzsölés hatására elolvadtak, egyszerű módon bizonyította, hogy a hő nem elem, hanem mechanikailag képezhető energia. A Volta oszlop fölfedezése után kezdte meg elektrokémiai kísérleteit. 1807-ben megolvasztott kálium-hidroxid elektrolízisével állított elő fém káliumot, még ugyanebben az évben nátrium-hidroxidból fém nátriumot. A következő évben hasonló módon kalciumot, stronciumot, báriumot és magnéziumot sikerült fölfedeznie. 1812-ben lovaggá ütötték és asszisztensével, Michael Faraday-vel európai körútra indult a vulkáni tevékenység tanulmányozására. (Michael Faraday (1791-1867) később a valaha élt legnagyobb kísérleti fizikussá nőtte ki magát) Franciaországban Napóleontól kitűntetést vett át annak ellenére, hogy országaik háborúban álltak egymással. Még ebben az évben fölfedezte a jódot. 1815-ben egy bányalátogatás közben a bányászok azzal a kéréssel fordultak hozzá, hogy fejlesszen ki egy olyan lámpát, aminek lángja nem okoz robbanást bányalég (metán) jelenlétében. Davy a lángot körülvevő kettős fémhálóval megoldotta a problémát és érdekes módon ez a bányászlámpa az egyetlen, ami a mai napig őrzi a nevét. 1820-1827 között a Royal Society elnöki tisztjét töltötte, korai halálát állítólag az általa fölfedezett kéjgáz túlzott élvezete okozta. A korszak talán legkiemelkedőbb kémikusa Jöns Jacob Berzelius (1799-1848) svéd kémikus volt, akit mai napig a svéd kémia atyjának tekintenek, szobra Stockholmban a Berzellii Park közepén áll. Szüleit korán elvesztette, rokonai nevelték fel. 1796-ban orvostant kezdett hallgatni az Uppsalai Egyetemen, ahol 1802-ben orvosi diplomát szerzett. Kémia tanára Anders Gustaf Ekeberg, a tantál felfedezője volt, akinek hatására figyelme egyre inkább a kémia felé fordult. Első kísérleteit Wilhelm Hisinger geológus bányatulajdonos laboratóriumában, Stockholmban végezte. 1807-ben a Karolinska Institute professzorává nevezték ki, 1808-ban a Svéd Királyi Tudományos Akadémia tagjává, 1810-ben elnökévé választották. Károly János király 1818-ban nemesi, majd 1835-ben bárói rangra emelte. Híres évkönyveiben („Jahres Bericht über die Fortschritte der Chemie und Mineralogie”) összefoglalta és rendszerezte a kémia eredményeit. Ő figyelte meg először, hogy az elektromos áram egyes vegyületek bomlását okozza, azaz felfedezte az elektrolízist. Kidolgozta az ionok és az ionos vegyületek elméletét. 1811-ben vezette be az elemek jelölésére a latin nevük első, illetve ütközés esetén első két betűjéből álló vegyjeleket, amelyeket kis módosítással a mai napig használunk. A tömegképletek írásakor az atomok számát felső indexbe tette, ma ez alsó indexbe kerül. Például a víz képlete nála H2O volt szemben a mai H2O írásmóddal. Összesen 43 elem relatív atomsúlyát határozta meg az oxigént véve 100 egységnek. 1828-ban korának legpontosabb atomtömeg-táblázatát publikálta. Felfedezte a szelént, a szilíciumot, a tóriumot és céziumot, tanítványai a lítiumot és vanádiumot. Számos vegyület összetételének meghatározása, több laboratóriumi eszköz és analitikai eljárás bevezetése fűződik nevéhez. Henry Hess (1802-1850) svájci születésű szentpétervári vegyész (nem tévesztendő össze Rudolf Hessel, aki nem kémikusként vált híressé) orvosként végzett a Tartui Egyetemen 1825-ben. Berzeliussal való találkozása után fordult a kémia felé és a Stockholmi Egyetemen hallgatta előadásait. Oroszországba visszatérve csatlakozott egy expedícióhoz az Ural geológiai tanulmányozására. 1830-tól kémiát tanított és kutatásokat végzett, később a Szentpétervári Technológiai Intézet Igazgatója lett. 1840-ben állította fel a kémiai reakciókban keletkező hőre vonatkozó, róla elnevezett Hess törvényt. „Valamely kémiai változás reakcióhőjét a kiindulási és a végállapot egyértelműen meghatározza, független a részfolyamatok minőségétől és sorrendjétől.” Olyasmi ez, mint a hegymászás. Teljesen mindegy, hogy szerpentinen gyalogoltál fel a hegycsúcsra, vagy toronyiránt kapaszkodtál fel, ha lezuhansz, egyformán töröd össze magadat. Ennek lényegét egy egyszerű példával, a szén elégetésével lehet illusztrálni.
C + O2 = CO2 reakcióhő = -393,5 kJ/mol C + 1/2O2 = CO reakcióhő = -110,5 kJ/mol CO + 1/2O2 = CO2 reakcióhő = -283,0 kJ/mol 393,5 = 283,0 + 110,5
Látható, hogy akár egy lépésben égetem el a szenet széndioxiddá, vagy először csak szénmonoxid képződik és ezt égetem tovább széndioxiddá, a végösszeg ugyanaz. Hess ezzel a törvénnyel megelőzte a termodinamika első főtételének kimondását, emiatt a termokémia úttörőjének tartják. Az előző képletekbe becsempésztem a „mol” jelölést, ami némi magyarázatra szorul. 1 mol jelenti grammokban 1 atom, vagy 1 molekula relatív tömegét. Tehát a szén „C” jelölése 12 g szenet, a „CO2” képlet 12 + 32 = 44 g széndioxidot jelent és így tovább. A mol tömegegységként való használata nem csak arra szolgál, hogy a vegyészek ne kavarják össze a reagáló komponensek arányát, hanem a kémiában fontos törvények megfogalmazását is megkönnyíti. A mol fogalmának mélyebb megértéséhez, a termodinamika főtételeinek kimondásához a gázokon keresztül vitt az út. A gázok olyanok a fizikai kémiában, mint az állatorvosi ló az állatgyógyászatban. Minden bajuk megvan, érzékenyen reagálnak külső behatásokra, reakcióik jól mérhetők. Tanulmányozásuk új lendületet kapott a század második felében, az eredményekből egy új tudományág nőtte ki magát a termodinamika. De ezekről a következő részben.
|
|
|
| Összes hozzászólás: 0 | |